อุบัติการณ์และปัจจัยที่มีความสัมพันธ์กับการเกิดอาการไม่พึงประสงค์หลังรับวัคซีนป้องกัน โรคติดเชื้อไวรัสโคโรนา 2019 ในประชาชนที่มารับวัคซีนที่หน่วยบริการโรงพยาบาลมหาราชนครศรีธรรมราช
คำสำคัญ:
อุบัติการณ์, อาการไม่พึงประสงค์หลังรับวัคซีน, วัคซีนป้องกันโรคติดเชื้อไวรัสโคโรนา 2019บทคัดย่อ
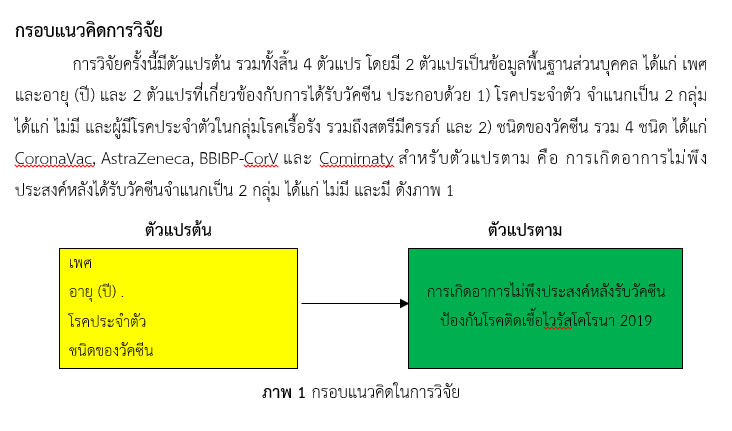
การวิจัยนี้เป็นการศึกษาย้อนหลังและไปข้างหน้า เพื่อศึกษาอุบัติการณ์การเกิดอาการไม่พึงประสงค์ ภายใน 30 วันหลังรับวัคซีนและปัจจัยที่มีความสัมพันธ์กับการเกิดอาการไม่พึงประสงค์หลังรับวัคซีนป้องกันโรคติดเชื้อไวรัสโคโรนา 2019 กลุ่มตัวอย่างเป็นประชาชนที่มารับวัคซีนที่หน่วยบริการโรงพยาบาลมหาราชนครศรีธรรมราช ระหว่างวันที่ 6 เมษายน พ.ศ. 2564 ถึง 31 สิงหาคม พ.ศ. 2564 จำนวน 15,438 คน เก็บรวบรวมข้อมูลจากแหล่งข้อมูลทุติยภูมิ คือฐานข้อมูลผู้รับบริการวัคซีนป้องกันโรคติดเชื้อไวรัสโคโรนา 2019 ของกระทรวงสาธารณสุข วิเคราะห์ข้อมูลด้วยสถิติเชิงพรรณนา และสถิติเชิงอนุมาน ได้แก่ Multiple logistic regression เพื่อนำเสนอขนาดความสัมพันธ์ที่ปรับอิทธิพลของตัวแปรอื่นด้วย Adjusted Odds Ratio (AOR) และช่วงความเชื่อมั่น 95% (95%CI)
ผลการศึกษา พบอุบัติการณ์การเกิดอาการไม่พึงประสงค์ภายใน 30 วันหลังรับวัคซีน ร้อยละ 31.42 โดยวัคซีนชนิด Comirnaty พบอุบัติการณ์สูงสุด ร้อยละ 51.90 อาการไม่พึงประสงค์ที่พบสูงสุด ได้แก่ ปวดกล้ามเนื้อ ร้อยละ 37.37 นอกจากนี้ ยังพบปัจจัยที่มีความสัมพันธ์กับการเกิดอุบัติการณ์อย่างมีนัยสำคัญทางสถิติ ได้แก่ เพศหญิง (AOR= 1.502, 95%CI: 1.392 - 1.621, p < 0.001) กลุ่มอายุน้อย 3 กลุ่ม ได้แก่ อายุ 18 – 29 ปี (AOR= 2.076, 95%CI: 1.870 - 2.306, p < 0.001) อายุ 30 – 39 ปี (AOR= 2.040, 95%CI: 1.848 - 2.251, p < 0.001) และอายุ 40 – 49 ปี (AOR= 1.531, 95%CI: 1.383 - 1.696, p < 0.001) และวัคซีน 2 ชนิด ได้แก่ AstraZeneca (AOR= 2.158, 95%CI: 1.978 - 2.354, p < 0.001) และ Comirnaty (AOR= 2.337, 95%CI: 1.949 - 2.900, p < 0.001)
ข้อค้นพบนี้ สามารถนำไปใช้วางแผนให้ข้อมูลอย่างเหมาะสมกับประชาชนทั้งที่ตัดสินใจเข้ารับบริการฉีดวัคซีนและยังลังเล ให้เกิดความเชื่อมั่น และรับรู้ถึงความปลอดภัยของการได้รับวัคซีน รวมถึงจัดเตรียมเวชภัณฑ์สนับสนุนที่เหมาะสมและเพียงพอกับการบรรเทาอาการไม่พึงประสงค์หลังรับวัคซีน
เอกสารอ้างอิง
Aryal, S., Devbhandari, R. P., Shrestha, A., Rajbhandari, P., Shakya, T., & Tuladhar, S., et al. (2021). Adverse events following immunization with sinopharm (Vero Cell) inactivated COVID-19 vaccine. Journal of Patan Academy of Health Sciences, 8(2), 18-24.
BBC NEWS. (2020). Coronavirus: WHO declares COVID-19 a global pandemic. Retrieved August 30, 2021 from https://www.bbc.com/thai/international-51838536. (in Thai)
Beatty, A., Peyser, D., Butcher, X., Cocohoba, J., Lin, F., & Olgin, J., et al. (2021). Analysis of COVID-19 vaccine type and adverse effects following vaccination. JAMA Network Open, 4(12): e2140364. http://doi:10.1001/jamanetworkopen.2021.40364.
Department of Disease Control. (2021). COVID-19 situation, public health measures and barriers to preventing and controlling the disease in Travelers. Retrieved August 30, 2021 from https://ddc.moph.go.th /uploads/files/2017420210820025238.pdf. (in Thai)
Department of Disease Control. (2021). Guidelines for vaccination against COVID-19 epidemic in Thailand 2021. Retrieved August 30, 2021 from https://cvp1.moph.go.th. (in Thai)
Gautam, A., Dangol, N., Bhattarai, U., Paudel, S., Poudel, B., & Gautam, S., et al. (2021). ChAdOx1 nCoV-19 vaccine and its self-reported adverse events: a cross-sectional study from Western Nepal. Journal of Patan Academy of Health Sciences, 8(2), 18-24.
Gold, M. S., Lincoln, G., Cashman, P., Braunack-Mayer, A., & Stocks, N. (2021). Efficacy of m-health for The detection of adverse events following immunization–the stimulated telephone assisted rapid safety surveillance (STARSS) randomised control trial. Vaccine, 39(2), 332-342.
Hospital Authority. (2021). Safety monitoring of COVID-19 vaccines in Hong Kong. Retrieved September 20, 2021 from https://www.covidvaccine.gov.hk/pdf/COVID19 Vaccination Fact Sheet_Comirnaty_ENG.pdf.
Jeong, M. (2021). Pfizer vaccine for COVID-19: what are the side effects?. Retrieved September 7, 2021 from https://www.medicalnewstoday.com/articles/pfizer-vaccine-for-covid-19- what-are-the-side-effects.
Karayeva, E., Kim, E., Bandy, U., Clyne, A., & Marak, T. P. (2021). Monitoring vaccine adverse event reporting system (VAERS) reports related to COVID-19 vaccination efforts in rhode Island. Rhode Island Medical Journal, 104(7), 64-66.
Meurs, L & Kant, A. (2021). Cohort event monitoring to assess safety of COVID-19 vaccines using patient reported events, a protocol template from the ACCESS project. Retrieved September 17, 2021 from https://cdn.who.int/media/docs/default-source/3rd-edl- submissions/who_covid_protocols_cem_template.pdf?sfvrsn=101d700d_1 & download =true.
Ministry of Health. (2021). MOPH immunization center. Retrieved September 1, 2021. from https://cvl1.moph.go.th. (in Thai)
Oh, H. K., Kim, E. K., Hwang, I., Kim, T. E., Lee, Y. K, & Lee, E., et al. (2021). COVID-19 vaccine Safety monitoring in the republic of Korea: February 26, 2021 to April 30, 2021. Osong Public Health and Research Perspectives, 12(4), 264-268.
Pike, H. (2021). Sinopharm COVID-19 vaccine: should you worry about the side effects?. Retrieved September 17, 2021 from https://www.medicalnewstoday.com/ articles/ sinopharm-covid-19-vaccine-should-you-worry-about-the-side-effects.
World Health Organization. (2020). COVID-19 WHO Thailand situation reports-12 March 2020. Retrieved August 30, 2021 from https://www.who.int/thailand/emergencies novel-coronavirus-2019/situation-reports. (in Thai)
ดาวน์โหลด
เผยแพร่แล้ว
เวอร์ชัน
- 2022-02-15 (2)
- 2022-02-07 (1)
รูปแบบการอ้างอิง
ฉบับ
ประเภทบทความ
สัญญาอนุญาต
ลิขสิทธิ์ (c) 2022 วิทยาลัยพยาบาลบรมราชชนนี นครศรีธรรมราช

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
บทความที่ได้รับการตีพิมพ์เป็นลิขสิทธิ์ของ วิทยาลัยพยาบาลบรมราชชนนี นครศรีธรรมราช
ข้อความที่ปรากฏในบทความแต่ละเรื่องในวารสารวิชาการเล่มนี้เป็นความคิดเห็นส่วนตัวของผู้เขียนแต่ละท่านไม่เกี่ยวข้องกับวิทยาลัยพยาบาลบรมราชชนนี นครศรีธรรมราช และบุคคลากรท่านอื่น ๆ ในวิทยาลัยฯ แต่อย่างใด ความรับผิดชอบองค์ประกอบทั้งหมดของบทความแต่ละเรื่องเป็นของผู้เขียนแต่ละท่าน หากมีความผิดพลาดใดๆ ผู้เขียนแต่ละท่านจะรับผิดชอบบทความของตนเองแต่ผู้เดียว





