Palopegteriparatide: ยาใหม่สำหรับการรักษาภาวะฮอร์โมนพาราไทรอยด์ต่ำเรื้อรังในผู้ใหญ่
คำสำคัญ:
palopegteriparatide, ภาวะฮอร์โมนพาราไทรอยด์ต่ำเรื้อรัง, ภาวะแคลเซียมในเลือดต่ำบทคัดย่อ
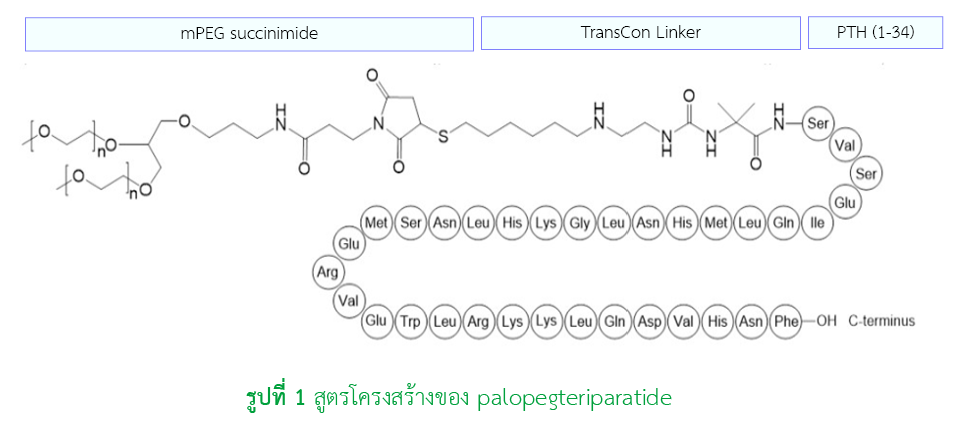
ในเดือนสิงหาคม ค.ศ.2024 ยาใหม่ที่มีชื่อสามัญว่า palopegteriparatide ได้รับการอนุมัติจากองค์การอาหารและยาแห่งสหรัฐอเมริกา ในข้อบ่งใช้สำหรับการรักษาภาวะฮอร์โมนพาราไทรอยด์ต่ำในผู้ใหญ่ และแนะนำให้ใช้เป็นฮอร์โมนพาราไทรอยด์ทดแทน ยาเป็น prodrug ของฮอร์โมนพาราไทรอยด์ ได้รับการพัฒนาขึ้นเพื่อให้ออกฤทธิ์ยาวนานขึ้น ทำให้ระดับฮอร์โมนพาราไทรอยด์ (1-34) ในเลือดคงอยู่ในร่างกาย 24 ชั่วโมง ส่งผลให้ยาสามารถควบคุมระดับแคลเซียมและฟอสเฟตในเลือดและระดับแคลเซียมในปัสสาวะให้ปกติ มีประสิทธิภาพในการรักษาผู้ป่วยที่มีภาวะฮอร์โมนพาราไทรอยด์ต่ำ และลดการใช้การรักษาแบบมาตรฐาน โดยสามารถหยุด active vitamin D และลดขนาด elemental calcium รับประทาน ≤ 600 มิลลิกรัมต่อวัน ทำให้ไม่ต้องรับประทานยาในปริมาณที่มากต่อวันและลดภาวะแทรกซ้อนในระยะยาว เช่น การแย่ลงของภาวะ hypercalciuria, renal insufficiency, ectopic calcification และสามารถเพิ่มคุณภาพชีวิตของผู้ป่วยได้ palopegteriparatide เป็นรูปแบบยาฉีดเข้าใต้ผิวหนัง วันละ 1 ครั้ง โดยให้ยาในขนาดแบบจำเพาะแต่ละบุคคล ขนาดยาเริ่มต้นคือ 18 ไมโครกรัม วันละ 1 ครั้ง การปรับขนาดยาควรปรับเพิ่มขึ้นหรือลดลงครั้งละ 3 ไมโครกรัม ห้ามเพิ่มขนาดยาบ่อยกว่า 7 วัน ห้ามลดขนาดยาบ่อยกว่า 3 วัน ขนาดยาที่แนะนำ คือ 6 - 30 ไมโครกรัม วันละ 1 ครั้ง ควรวัดระดับแคลเซียมในเลือดภายใน 7 - 10 วันหลังจากได้รับยาครั้งแรก และทุกครั้งที่มีการปรับขนาด palopegteriparatide, active vitamin D หรือ calcium supplement และควรมีการติดตามอาการของแคลเซียมในเลือดต่ำหรือสูง อาการข้างเคียงที่อาจพบได้ (อุบัติการณ์ ≥ ร้อยละ 5) คือ อาการช้ำแดง ผื่นในตำแหน่งที่ฉีดยา อาการและอาการแสดงเส้นเลือดขยาย (เช่น ภาวะความดันต่ำจากการเปลี่ยนท่า อาการวิงเวียนศีรษะ อาการใจสั่น อาการหัวใจเต้นเร็วเมื่อเปลี่ยนท่า) ปวดศีรษะ ท้องเสีย อาการปวดหลัง (เช่น อาการปวดหลัง ปวดเอว ปวดกระดูกสันหลัง) ภาวะแคลเซียมในเลือดสูง อาการปวดบริเวณช่องปากและลำคอ
เอกสารอ้างอิง
Bilezikian JP, Khan A, Potts JT, Brandi ML, Clarke BL, Shoback D, et al. Hypoparathyroidism in the adult: epidemiology, diagnosis, pathophysiology, target organ involvement, treatment, and challenges for future research. J Bone Miner Res. 2011;26(10):2317-37. doi: 10.1002/jbmr.483.
Clarke BL, Brown EM, Collins MT, Juppner H, Lakatos P, Levine MA, et al. Epidemiology and diagnosis of hypoparathyroidism. J Clin Endocrinol Metab. 2016;101(6):2284-99. doi: 10.1210/jc.2015-3908.
Goyal A, Anastasopoulou C, Ngu M, Singh S. Hypocalcemia. In: StatPearls [internet]. Treasure Island (FL): StatPearls Publishing; 2023 [cited 2025 Jan 30]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK430912/
Bollerslev J, Rejnmark L, Marcocci C, Shoback DM, Stiges-Serra A, van Biesen W, et al. European Society of Endocrinology clinical guideline: treatment of chronic hypoparathyroidism in adults. Eur J Endocrinol. 2015;173(2):G1-20. doi: 10.1530/EJE-15-0628.
Brandi ML, Bilezikian JP, Shoback D, Bouilon R, Clarke BL, Thakker RV, et al. Management of hypoparathyroidism: summary statement and guidelines. J Clin Endocrinol Metab. 2016;101(6):2273-83. doi: 10.1210/jc.2015-3907.
Bilezikian JP, Brandi ML, Cusano NE, Mannstadt M, Rejnmark L, Rizzoli R, et al. Management of hypoparathyroidism: present and future. J Clin Endocrinol Metab. 2016;101(6):2313-24. doi: 10.1210/jc.2015-3910.
Abate EG, Clarke BL. Review of hypoparathyroidism. Front Endocrinol (Lausanne). 2017;7:172. doi: 10.3389/fendo.2016.00172.
Clarke BL. Hypoparathyroidism: update of guidelines from the 2022 international task force 2022. Arch Endocrinol Metab. 2022;66(5):604-10. doi: 10.20945/2359-3997000000549.
Rejnmark L. Treatment of hypoparathyroidism by re-establishing the effects of parathyroid hormone. Endocrinol Metab (Seoul). 2024;39(2):262-6. doi: 10.3803/EnM.2024.1916.
Charoenngam N, Bove-Fenderson E, Wong D, Cusano NE, Mannstadt M. Continuous subcutaneous delivery of rhPTH (1-84) and rhPTH (1-34) by pump in adults with hypoparathyroidism. J Endocr Soc. 2024;8(5):bvae053. doi: 10.1210/jendso/bvae053.
Cusano NE, Rubin MR, Bilezikian JP. PTH (1-84) replacement therapy for the treatment of hypoparathyroidism. Expert Rev Endocrinol Metab. 2015;10(1):5-13. doi: 10.1586/17446651.2015.971755.
Holten-Andersen L, Pihl S, Rasmussen CE, Zettler J, Maitro G, Baron J, et al. Design and preclinical development of TransCon PTH, an investigational sustained-release PTH replacement therapy for hypoparathyroidism. J Bone Miner Res. 2019;34(11):2075-86. doi: 10.1002/jbmr.3824.
Karpf BD, Pihl S, Mourya S, Mortensen E, Kovoor E, Markova D, et al. A randomized double-blind placebo-controlled first-in-human phase 1 trial of TransCon PTH in healthy adults. J Bone Miner Res. 2020;35(8):1430-40. doi: 10.1002/jbmr.4016.
Khan AA, Rubin MR, Schwarz P, Vokes T, Shoback DM, Gagnon C, et al. Efficacy and safety of parathyroid hormone replacement with TransCon PTH in hypoparathyroidism: 26-week results from the phase 3 PaTHway trial. J Bone Miner Res. 2023;38(1):14-25. doi: 10.1002/jbmr.4726.
Ascendis Pharma Endocrinology Inc. YORVIPATH® (palopegteriparatide) injection, for subcutaneous use [internet]. n.p.: U.S. Food and Drug Administration; 2024 [cited 2025 Jan 30]. Available from: https://www.accessdata.fda.gov/drugsatfda_docs/label/2024/216490s000lbl.pdf
UpToDate. YORVIPATH® (palopegteriparatide) [internet]. n.p.: UpToDate, Inc.; 2025 [cited 2025 Jul 19]. Available from: http://www.uptodate.com/contents/palopegteriparatide-drug-information/print?search=Palopegteriparatide&source=panel search result&select [for subscriber]
Medscape. Palopegteriparatide [internet]. n.p.: Medscape Inc.; 2025 [cited 2025 Aug 8]. Available from: https://reference.medscape.com/drug/yorvipath-paloperiparatide-4000335#0
Clarke BL, Khan AA, Rubin RM, Schwarz P, Vokes T, Shoback DM, et al. Efficacy and safety of TransCon PTH in adults with hypoparathyroidism: 52-week results from the phase 3 PaTHway trial. J Clin Endocrinol Metab. 2025;110(4):951-60. doi: 10.1210/clinem/dgae693.
European Medical Agency (EMA). Assessment report for YORVIPATH® (palopegteriparatide) [internet]. Amsterdam: EMA; 2025 [cited 2025 Aug 8]. Available from: https://www.ema.europa.eu/en/documents/product-information/yorvipath-epar-product-information_en.pdf
ดาวน์โหลด
เผยแพร่แล้ว
รูปแบบการอ้างอิง
ฉบับ
ประเภทบทความ
สัญญาอนุญาต
ลิขสิทธิ์ (c) 2025 สมาคมเภสัชกรรมโรงพยาบาล(ประเทศไทย)

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
ข้อความภายในบทความที่ตีพิมพ์ในวารสารเภสัชกรรมโรงพยาบาลทั้งหมด รวมถึงรูปภาพประกอบ ตาราง เป็นลิขสิทธิ์ของสมาคมเภสัชกรรมโรงพยาบาล (ประเทศไทย) การนำเนื้อหา ข้อความหรือข้อคิดเห็น รูปภาพ ตาราง ของบทความไปจัดพิมพ์เผยแพร่ในรูปแบบต่าง ๆ เพื่อใช้ประโยชน์ในเชิงพาณิชย์ ต้องได้รับอนุญาตจากกองบรรณาธิการวารสาร (สมาคมเภสัชกรรมโรงพยาบาล (ประเทศไทย)) อย่างเป็นลายลักษณ์อักษร
สมาคมเภสัชกรรมโรงพยาบาล (ประเทศไทย) อนุญาตให้สามารถนำไฟล์บทความไปใช้ประโยชน์และเผยแพร่ต่อได้ โดยอยู่ภายใต้เงื่อนไขสัญญาอนุญาตครีเอทีฟคอมมอน (Creative Commons License: CC) โดย ต้องแสดงที่มาจากวารสาร – ไม่ใช้เพื่อการค้า – ห้ามแก้ไขดัดแปลง, Attribution-NonCommercial-NoDerivatives 4.0 International (CC BY-NC-ND 4.0)
ข้อความที่ปรากฏในบทความในวารสารเป็นความคิดเห็นส่วนตัวของผู้เขียนแต่ละท่านไม่เกี่ยวข้องกับสมาคมเภสัชกรรมโรงพยาบาล (ประเทศไทย) และบุคลากรในสมาคมฯ แต่อย่างใด ความรับผิดชอบองค์ประกอบทั้งหมดของบทความแต่ละเรื่องเป็นของผู้เขียนแต่ละท่าน หากมีความผิดพลาดใด ๆ ผู้เขียนแต่ละท่านจะรับผิดชอบบทความของตนเอง ตลอดจนความรับผิดชอบด้านเนื้อหาและการตรวจร่างบทความเป็นของผู้เขียน ไม่เกี่ยวข้องกับกองบรรณาธิการ


.png)

