Tixagevimab/Cilgavimab: โมโนโคลนอลแอนติบอดีในโรคติดเชื้อไวรัสโคโรนา 2019 (โควิด-19)
คำสำคัญ:
โมโนโคลนอลแอนติบอดี, เชื้อไวรัสโคโรนา 2019, โปรตีนหนาม, tixagevimab, cilgavimabบทคัดย่อ
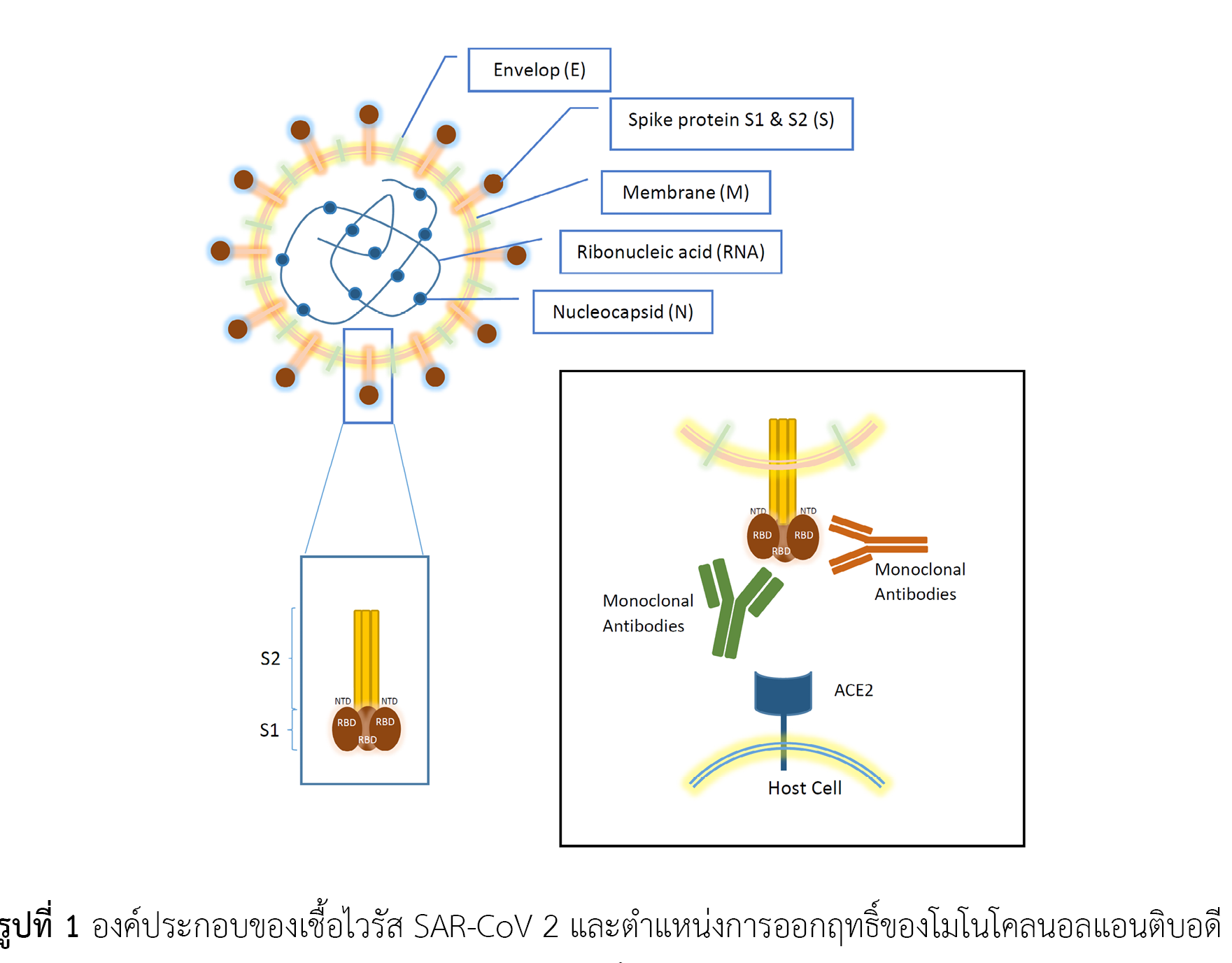
การให้โมโนโคลนอลแอนติบอดีเป็นการให้ภูมิคุ้มกันโดยตรงเพื่อต้านเชื้อไวรัสที่เป็นสาเหตุของโรคติดเชื้อไวรัสโคโรนา 2019 ทำให้สามารถออกฤทธิ์ยับยั้งเชื้อได้ทันทีโดยไม่ต้องกระตุ้นระบบภูมิคุ้มกันของร่างกาย จึงเป็นทางเลือกสำหรับผู้ที่ไม่สามารถรับวัคซีน เช่น ผู้ป่วยที่แพ้วัคซีน หรือผู้ป่วยที่อาจเกิดภูมิคุ้มกันตอบสนองต่อวัคซีนในระดับต่ำ ได้แก่ ผู้ป่วยปลูกถ่ายอวัยวะ ผู้ป่วยมะเร็ง ผู้ป่วยที่มีภาวะภูมิคุ้มกันต่ำ ผู้ป่วยกลุ่มนี้มีความเสี่ยงสูงที่เมื่อติดเชื้อไวรัสโคโรนา 2019 แล้วจะมีอาการรุนแรง โมโนโคลนอลแอนติบอดีออกฤทธิ์โดยจับกับโปรตีนตรงส่วนหนาม ที่ผิวของอนุภาคไวรัส ซึ่งเป็นตำแหน่งที่มีการกลายพันธุ์ได้บ่อย ในปัจจุบันเชื้อไวรัสสายพันธุ์หลักที่มีการระบาด มากกว่าร้อยละ 80 คือ สายพันธุ์โอมิครอนสายพันธุ์ย่อย BA.4 และ BA.5 จึงนำมาสู่การใช้ tixagevimab/cilgavimab ซึ่งเป็นโมโนโคลนอลแอนติบอดีแบบผสมที่มีฤทธิ์ยาว ออกฤทธิ์ยับยั้งเชื้อไวรัสโคโรนา 2019 สายพันธุ์โอมิครอนสายพันธุ์ย่อย BA.4 และ BA.5 ได้ดี ได้รับการขึ้นทะเบียนภาวะฉุกเฉินในสหรัฐอเมริกา สำหรับป้องกันก่อนการสัมผัสโรคติดเชื้อไวรัสโคโรนา 2019 เมื่อติดตามประสิทธิผลที่ 6 เดือนหลังจากที่ได้รับยา พบว่าสามารถป้องกันการติดเชื้อไวรัสโคโรนา 2019 ได้ดีกว่ากลุ่มที่ได้รับยาหลอก แต่ยังต้องมีการติดตามข้อมูลเหตุการณ์ไม่พึงประสงค์ระยะยาวเพิ่มเติมต่อไป
เอกสารอ้างอิง
Boyarsky BJ, Werbel WA, Avery RK, Tobian AAR, Massie AB, Segev DL, et al. Antibody response to 2-dose SARS-CoV-2 mRNA vaccine series in solid organ transplant recipients. JAMA. 2021;325(21):2204-6. doi: 10.1001/jama.2021.7489.
Kamar N, Abravanel F, Marion O, Couat C, Izopet J, Del Bello A. Three doses of an mRNA covid-19 vaccine in solid-organ transplant recipients. N Engl J Med. 2021;385(7):661-2. doi: 10.1056/NEJMc2108861.
Agha ME, Blake M, Chilleo C, Wells A, Haidar G. Suboptimal response to coronavirus disease 2019 messenger RNA vaccines in patients with hematologic malignancies: a need for vigilance in the postmasking era. Open Forum Infect Dis. 2021;8(7):ofab353. doi: 10.1093/ofid/ofab353.
Herishanu Y, Avivi I, Aharon A, Shefer G, Levi S, Bronstein Y, et al. Efficacy of the BNT162b2 mRNA COVID-19 vaccine in patients with chronic lymphocytic leukemia. Blood. 2021;137(23):3165-73. doi: 10.1182/blood.2021011568.
Chan L, Fuca N, Zeldis E, Campbell KN, Shaikh A. Antibody response to mRNA-1273 SARS-CoV-2 vaccine in hemodialysis patients with and without prior COVID-19. Clin J Am Soc Nephrol. 2021;16(8):1258-60. doi: 10.2215/CJN.04080321.
Wang L, Wang Y, Ye D, Liu Q. Review of the 2019 novel coronavirus (SARS-CoV-2) based on current evidence. Int J Antimicrob Agents. 2020;55(6):105948. doi: 10.1016/j.ijantimicag.2020.105948.
Quiros-Roldan E, Amadasi S, Zanella I, Degli Antoni M, Storti S, Tiecco G, et al. Monoclonal antibodies against SARS-CoV-2: current scenario and future perspectives. Pharmaceuticals (Basel). 2021;14(12):1272. doi: 10.3390/ph14121272.
Huang Y, Yang C, Xu XF, Xu W, Liu SW. Structural and functional properties of SARS-CoV-2 spike protein: potential antivirus drug development for COVID-19. Acta Pharmacol Sin. 2020;41(9):1141-9. doi: 10.1038/s41401-020-0485-4.
Holmes KV. SARS-associated coronavirus. N Engl J Med. 2003;348(20):1948-51. doi: 10.1056/NEJMp030078.
Tay MZ, Poh CM, Rénia L, MacAry PA, Ng LFP. The trinity of COVID-19: immunity, inflammation and intervention. Nat Rev Immunol. 2020;20(6):363-74. doi: 10.1038/s41577-020-0311-8.
Sanders JM, Monogue ML, Jodlowski TZ, Cutrell JB. Pharmacologic treatments for coronavirus disease 2019 (COVID-19): a review. JAMA. 2020;323(18):1824-36. doi: 10.1001/jama.2020.6019.
He F, Deng Y, Li W. Coronavirus disease 2019: what we know? J Med Virol. 2020;92(7):719-25. doi: 10.1002/jmv.25766.
Millet JK, Whittaker GR. Physiological and molecular triggers for SARS-CoV membrane fusion and entry into host cells. Virology. 2018;517:3-8. doi: 10.1016/j.virol.2017.12.015.
Guo YR, Cao QD, Hong ZS, Tan YY, Chen SD, Jin HJ, et al. The origin, transmission and clinical therapies on coronavirus disease 2019 (COVID-19) outbreak - an update on the status. Mil Med Res. 2020;7(1):11. doi: 10.1186/s40779-020-00240-0.
Ciottia M, Angelettib S, Minieri M, Giovannetti M, Benvenuto D, Pascarella S, et al. COVID-19 outbreak: an overview. Chemotherapy. 2019;64(5-6):215-23. doi: 10.1159/000507423.
Taylor PC, Adams AC, Hufford MM, de la Torre I, Winthrop K, Gottlieb RL. Neutralizing monoclonal antibodies for treatment of COVID-19. Nat Rev Immunol. 2021;21(6):382-93. doi: 10.1038/s41577-021-00542-x.
Levin MJ, Ustianowski A, De Wit S, Launay O, Avila M, Templeton A, et al. Intramuscular AZD7442 (tixagevimab-cilgavimab) for prevention of covid-19. N Engl J Med. 2022;386(23):2188-200. doi: 10.1056/NEJMoa2116620.
AstraZeneca. Evusheld®: summary of product characteristics. In: European Medicines Agency [Internet]. Amsterdam: European Medicines Agency; 2022 [cited 2023 Jan 26]. Available from: https://www.ema.europa.eu/en/medicines/human/EPAR/evusheld
AstraZeneca. Fact sheet for healthcare providers: emergency use authorization for Evusheld™ [Internet]. Silver Spring, Maryland: U.S. Food and Drug Administration; 2021 [cited 2022 Sep 16]. Available from: https://www.fda.gov/media/154701/download
กรมควบคุมโรค. แนวทางการให้ long acting antibody (LAAB) ในประเทศไทย พ.ศ. 2565 [อินเทอร์เนต]. นนทบุรี: กรมควบคุมโรค กระทรวงสาธารณสุข. 2565 [สืบค้นเมื่อ 10 กันยายน 2565]. สืบค้นจาก: https://ddc.moph.go.th/uploads/publish/1294120220722013551.pdf
AstraZeneca. Update on AZD7442 STORM CHASER trial in post-exposure prevention of symptomatic COVID-19 [Internet]. Cambridge: AstraZeneca; 2021 [cited 2022 Sep 16]. Available from: https://www.astrazeneca.com/media-centre/press-releases/2021/update-on-azd7442-storm-chaser-trial.html
Montgomery H, Hobbs FDR, Padilla F, Arbetter D, Templeton A, Seegobin S, et al. Efficacy and safety of intramuscular administration of tixagevimab-cilgavimab for early outpatient treatment of COVID-19 (TACKLE): a phase 3, randomised, double-blind, placebo-controlled trial. Lancet Respir Med. 2022;10(10):985-96. doi: 10.1016/S2213-2600(22)00180-1.
WHO Working Group on the Clinical Characterisation and Management of COVID-19 infection. A minimal common outcome measure set for COVID-19 clinical research. Lancet Infect Dis. 2020;20(8):e192-7. doi: 10.1016/S1473-3099(20)30483-7.
สำนักงานปลัดกระทรวงสาธารณสุข. สธ.เผยผลศึกษาแอนติบอดี "Evusheld" ป้องกันโควิดในผู้มีภาวะภูมิคุ้มกันบกพร่อง มีความคุ้มค่าในผู้ป่วยล้างไต เตรียมนำมาใช้เพื่อลดการเสียชีวิต [อินเทอร์เนต]. นนทบุรี: สำนักสารนิเทศ สำนักงานปลัดกระทรวงสาธารณสุข; 2565 [สืบค้นเมื่อ 28 มกราคม 2566]. สืบค้นจาก: https://pr.moph.go.th/?url=pr/detail/2/04/175291/
Tao K, Tzou PL, Kosakovsky Pond SL, Ioannidis JPA, Shafer RW. Susceptibility of SARS-CoV-2 Omicron variants to therapeutic monoclonal antibodies: systematic review and meta-analysis. Microbiol Spectr. 2022;10(4):e0092622. doi: 10.1128/spectrum.00926-22.
Takashita E, Yamayoshi S, Simon V, van Bakel H, Sordillo EM, Pekosz A, et al. Efficacy of antibodies and antiviral drugs against Omicron BA.2.12.1, BA.4, and BA.5 subvariants. N Engl J Med. 2022;387(5):468-70. doi: 10.1056/NEJMc2207519.
Wang Q, Guo Y, Iketani S, Nair MS, Li Z, Mohri H, et al. Antibody evasion by SARS-CoV-2 Omicron subvariants BA.2.12.1, BA.4 and BA.5. Nature. 2022;608(7923):603-8. doi: 10.1038/s41586-022-05053-w.
National Institutes of Health. Anti-SARS-CoV-2 Monoclonal Antibodies. In: NIH COVID-19 Treatment Guidelines [Internet]. Bethesda, Maryland: National Institutes of Health; 2022 [cited 2022 Sep 16]. Available from: https://www.covid19treatmentguidelines.nih.gov/therapies/antivirals-including-antibody-products/anti-sars-cov-2-monoclonal-antibodies/
ดาวน์โหลด
เผยแพร่แล้ว
รูปแบบการอ้างอิง
ฉบับ
ประเภทบทความ
สัญญาอนุญาต
ลิขสิทธิ์ (c) 2023 สมาคมเภสัชกรรมโรงพยาบาล(ประเทศไทย)

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
ข้อความภายในบทความที่ตีพิมพ์ในวารสารเภสัชกรรมโรงพยาบาลทั้งหมด รวมถึงรูปภาพประกอบ ตาราง เป็นลิขสิทธิ์ของสมาคมเภสัชกรรมโรงพยาบาล (ประเทศไทย) การนำเนื้อหา ข้อความหรือข้อคิดเห็น รูปภาพ ตาราง ของบทความไปจัดพิมพ์เผยแพร่ในรูปแบบต่าง ๆ เพื่อใช้ประโยชน์ในเชิงพาณิชย์ ต้องได้รับอนุญาตจากกองบรรณาธิการวารสาร (สมาคมเภสัชกรรมโรงพยาบาล (ประเทศไทย)) อย่างเป็นลายลักษณ์อักษร
สมาคมเภสัชกรรมโรงพยาบาล (ประเทศไทย) อนุญาตให้สามารถนำไฟล์บทความไปใช้ประโยชน์และเผยแพร่ต่อได้ โดยอยู่ภายใต้เงื่อนไขสัญญาอนุญาตครีเอทีฟคอมมอน (Creative Commons License: CC) โดย ต้องแสดงที่มาจากวารสาร – ไม่ใช้เพื่อการค้า – ห้ามแก้ไขดัดแปลง, Attribution-NonCommercial-NoDerivatives 4.0 International (CC BY-NC-ND 4.0)
ข้อความที่ปรากฏในบทความในวารสารเป็นความคิดเห็นส่วนตัวของผู้เขียนแต่ละท่านไม่เกี่ยวข้องกับสมาคมเภสัชกรรมโรงพยาบาล (ประเทศไทย) และบุคลากรในสมาคมฯ แต่อย่างใด ความรับผิดชอบองค์ประกอบทั้งหมดของบทความแต่ละเรื่องเป็นของผู้เขียนแต่ละท่าน หากมีความผิดพลาดใด ๆ ผู้เขียนแต่ละท่านจะรับผิดชอบบทความของตนเอง ตลอดจนความรับผิดชอบด้านเนื้อหาและการตรวจร่างบทความเป็นของผู้เขียน ไม่เกี่ยวข้องกับกองบรรณาธิการ


.png)

