Pharmacological Treatment of Osteoporosis
Keywords:
osteoporosis, antiresorptive agents, osteoanabolic agents, osteoporotic fractureAbstract
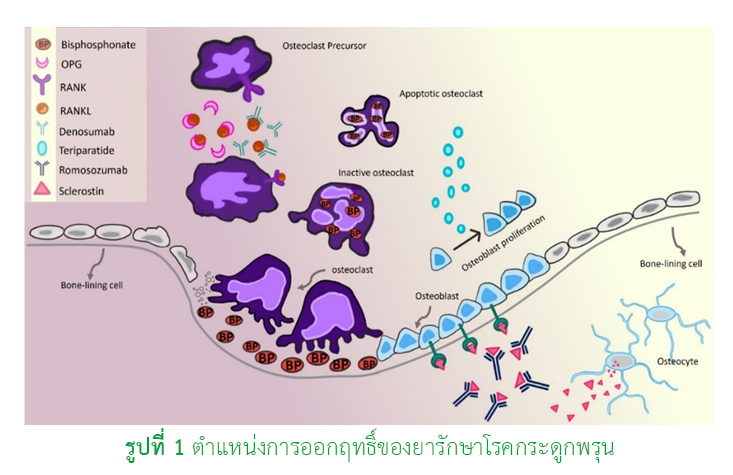
Osteoporosis is a significant public health concern. It results from a metabolic disorder of bone remodeling, leading to decreased bone mineral density and an increased risk of fractures, particularly among the elderly. Medications used in the treatment of osteoporosis primarily work by either inhibiting osteoclast activity to reduce bone resorption or stimulating bone formation through osteoblast activity. The selection of appropriate treatment should be based on an individual’s fracture risk and bone mineral density. As recommended in the 2021 Clinical Practice Guidelines for the Management of Osteoporosis issued by the Osteoporosis Foundation of Thailand, antiresorptive agents, particularly bisphosphonates, are recommended as the first-line treatment for individuals at high risk of fractures. For patients who are unable to tolerate bisphosphonates, denosumab may be considered as an alternative option. In individuals at very high fracture risk, continuous therapy is recommended, starting with bone-forming agents which are teriparatide or romosozumab, followed by antiresorptive therapy with bisphosphonates or denosumab to sustain the treatment effect and prevent fractures. However, it is essential to carefully consider each medication’s indications, potential adverse effects, limitations, precautions, contraindications, and the patient’s adherence to therapy to ensure effective osteoporosis management.
References
NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis, and Therapy. Osteoporosis prevention, diagnosis, and therapy. JAMA. 2001;285(6):785–95. doi:10.1001/jama.285.6.785.
Langdahl BL. Overview of treatment approaches to osteoporosis. Br J Pharmacol. 2021;178(9):1891-906. doi: 10.1111/bph.15024.
Barnsley J, Buckland G, Chan PE, Ong A, Ramos AS, Baxter M, et al. Pathophysiology and treatment of osteoporosis: challenges for clinical practice in older people. Aging Clin Exp Res. 2021;33(4):759-73. doi: 10.1007/s40520-021-01817-y.
Kanis JA. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis: synopsis of a WHO report. Osteoporos Int. 1994;4(6):368-81. doi: 10.1007/BF01622200.
Kanis JA, Johnell O, De Laet C, Johansson H, Oden A, Delmas P, et al. A meta-analysis of previous fracture and subsequent fracture risk. Bone. 2004;35(2):375-82. doi: 10.1016/j.bone.2004.03.024.
มูลนิธิโรคกระดูกพรุนแห่งประเทศไทย. คำแนะนำเวชปฏิบัติการดูแลรักษาโรคกระดูกพรุน พ.ศ. 2564. กรุงเทพมหานคร: มูลนิธิโรคกระดูกพรุนแห่งประเทศไทย; 2565.
University of Sheffield. Fracture risk assessment tool [Internet]. Sheffield: University of Sheffield; 2019 [cited 2024 Oct 11]. Available from: https://frax.shef.ac.uk/frax/tool.aspx?country=57
IOF. Calcium patient factsheet [Internet]. Nyon: International Osteoporosis Foundation (IOF); 2019 [cited 2025 Mar 31]. Available from: https://www.osteoporosis.foundation/system/files/eh/2019-12/Patient_calcium-factsheet.pdf
Boucher BJ. The problems of vitamin D insufficiency in older people. Aging Dis. 2012;3(4):313-29. PMID: 23185713.
Schwinghammer TL. Chapter 3. Osteoporosis. In: Schwinghammer TL, DiPiro JT, Ellingrod VL, DiPiro CV, editors. Pharmacotherapy handbook. 11th ed [Internet]. n.p.: McGraw Hill.; 2021. [cited 2023 Jul 14]. Available from: https://accesspharmacy.mhmedical.com/content.aspx?bookid=3012§ionid=253433831
Weaver CM, Alexander DD, Boushey CJ, Dawson-Hughes B, Lappe JM, LeBoff MS, et al. Calcium plus vitamin D supplementation and risk of fractures: an updated meta-analysis from the National Osteoporosis Foundation. Osteoporos Int. 2016;27(1):367-76. doi: 10.1007/s00198-015-3386-5.
Miller PD, Jamal SA, Evenepoel P, Eastell R, Boonen S. Renal safety in patients treated with bisphosphonates for osteoporosis: a review. J Bone Miner Res. 2013;28(10):2049-59. doi: 10.1002/jbmr.2058.
Wang M, Wu YF, Girgis CM. Bisphosphonate drug holidays: evidence from clinical trials and real-world studies. JBMR Plus. 2022;6(6):e10629. doi: 10.1002/jbm4.10629.
Amgen Inc. PROLIA® (denosumab) injection, for subcutaneous use [Internet]. n.p.: U.S. Food and Drug Administration; 2022 [cited 2023 Jul 23]. Available from: https://www.accessdata.fda.gov/drugsatfda_docs/label/2023/125320Orig1s211lbl.pdf
Tsourdi E, Yu EW, Jan de Beur SM, Drake MT. Vaccination for coronavirus disease 2019 (COVID-19) and relationship to osteoporosis care: current evidence and suggested approaches. J Bone Miner Res. 2021;36(6):1042-7. doi: 10.1002/jbmr.4304.
Hodsman AB, Bauer DC, Dempster DW, Dian L, Hanley DA, Harris ST, et al. Parathyroid hormone and teriparatide for the treatment of osteoporosis: a review of the evidence and suggested guidelines for its use. Endocr Rev. 2005;26(5):688-703. doi: 10.1210/er.2004-0006.
Amgen. Evenity® [Package insert]. Bangkok: Amgen (Thailand) Ltd.; 2020.
Organon. Fosamax® Plus [Package insert]. Bangkok: Organon (Thailand) Ltd.; 2023.
Zuellig pharma. Actonel® [Package insert]. Bangkok: Zuellig pharma Ltd.; 2019.
DKSH. Bonviva® [Package insert]. Bangkok: DKSH (Thailand) Ltd; 2019.
Genentech (USA) Inc. BONIVA® (ibandronate sodium) injection, for intravenous use [Internet]. n.p.: U.S. Food and Drug Administration; 2022 [cited 2023 Jul 23]. Available from: https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/021858Orig1s023lbl.pdf
Alvogen. Aclasta® [Package insert]. Bangkok: Alvogen (Thailand) Ltd; 2018.
Lilly (USA) Llc. FORTEO® (teriparatide) injection, for subcutaneous use [Internet]. n.p.: U.S. Food and Drug Administration; 2021[cited 2023 Jul 23]. Available from: https://www.accessdata.fda.gov/drugsatfda_docs/label/2021/021318Orig1s056lbl.pdf
Vaisman-Mentesh A, Gutierrez-Gonzalez M, DeKosky BJ, Wine Y. The molecular mechanisms that underlie the immune biology of anti-drug antibody formation following treatment with monoclonal antibodies. Front Immunol. 2020;11:1951. doi: 10.3389/fimmu.2020.01951.
Downloads
Published
How to Cite
Issue
Section
License
Copyright (c) 2025 Association of Hospital Pharmacy (Thailand)

This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
ข้อความภายในบทความที่ตีพิมพ์ในวารสารเภสัชกรรมโรงพยาบาลทั้งหมด รวมถึงรูปภาพประกอบ ตาราง เป็นลิขสิทธิ์ของสมาคมเภสัชกรรมโรงพยาบาล (ประเทศไทย) การนำเนื้อหา ข้อความหรือข้อคิดเห็น รูปภาพ ตาราง ของบทความไปจัดพิมพ์เผยแพร่ในรูปแบบต่าง ๆ เพื่อใช้ประโยชน์ในเชิงพาณิชย์ ต้องได้รับอนุญาตจากกองบรรณาธิการวารสาร (สมาคมเภสัชกรรมโรงพยาบาล (ประเทศไทย)) อย่างเป็นลายลักษณ์อักษร
สมาคมเภสัชกรรมโรงพยาบาล (ประเทศไทย) อนุญาตให้สามารถนำไฟล์บทความไปใช้ประโยชน์และเผยแพร่ต่อได้ โดยอยู่ภายใต้เงื่อนไขสัญญาอนุญาตครีเอทีฟคอมมอน (Creative Commons License: CC) โดย ต้องแสดงที่มาจากวารสาร – ไม่ใช้เพื่อการค้า – ห้ามแก้ไขดัดแปลง, Attribution-NonCommercial-NoDerivatives 4.0 International (CC BY-NC-ND 4.0)
ข้อความที่ปรากฏในบทความในวารสารเป็นความคิดเห็นส่วนตัวของผู้เขียนแต่ละท่านไม่เกี่ยวข้องกับสมาคมเภสัชกรรมโรงพยาบาล (ประเทศไทย) และบุคลากรในสมาคมฯ แต่อย่างใด ความรับผิดชอบองค์ประกอบทั้งหมดของบทความแต่ละเรื่องเป็นของผู้เขียนแต่ละท่าน หากมีความผิดพลาดใด ๆ ผู้เขียนแต่ละท่านจะรับผิดชอบบทความของตนเอง ตลอดจนความรับผิดชอบด้านเนื้อหาและการตรวจร่างบทความเป็นของผู้เขียน ไม่เกี่ยวข้องกับกองบรรณาธิการ


.png)

